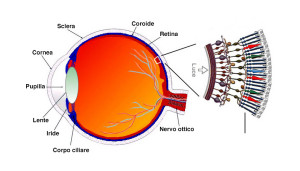
Che cos’è il Monocromatismo dei Coni Blu?
Il Monocromatismo dei Coni Blu (Blue Cone Monochromacy o BCM) è una malattia genetica rara della retina che si stima colpisca una persona su 100.000.
Si tratta di una degenerazione retinica ereditaria (IRD) causata da mutazioni nel gruppo di geni OPN1LW/OPN1MW, che codificano le proteine opsin sensibili alle lunghezze d’onda lunga (L) e media (M) (ovvero, rossa e verde) [38,39,41] dei fotorecettori della retina, i coni.
Le disabilità visive sono significative e comprendono una ridotta acuità visiva, visione anormale dei colori, miopia, nistagmo e fotofobia [11,20,21,34,52].
Il Monocromatismo dei Coni Blu colpisce la retina, sul retro dell’occhio
È una malattia recessiva legata al cromosoma X, di conseguenza colpisce quasi esclusivamente i maschi (XY) mentre le femmine portatrici (XX) solo raramente mostrano alcuni dei sintomi, in forma lieve.
Il Monocromatismo dei Coni Blu è solitamente considerato una malattia stazionaria i cui sintomi si manifestano per la prima volta durante l’infanzia, anche se esistono dei dati che indicano una progressione della malattia con cambiamenti maculari associati alla degenerazione maculare in molti pazienti [5, 6 ,34,52]. Il primo sintomo osservato è il nistagmo nei neonati di 2-3 mesi.
Il video che mostra il nistagmo in un bambino di 4 mesi affetto da Monocromatismo dei Coni Blu
Sintomi
Nella retina umana sono presenti tre tipi di coni, responsabili della visione diurna, dell’acuità visiva e della visione dei colori: sono sensibili alla luce di lunghezza d’onda Lunga (rosso), Media (verde) e corta o Short (blu) [41]. Quando le persone sono affette da Monocromatismo dei Coni Blu, sia i coni rossi che quelli verdi non funzionano correttamente, mentre i coni blu funzionano regolarmente [5,38,39]. I sintomi possono includere bassa acuità visiva (chiarezza o nitidezza), alterazione della visione dei colori, fotofobia (sensibilità alla luce), miopia (difficoltà a mettere a fuoco gli oggetti lontani) e nistagmo (movimenti rapidi e incontrollabili dell’occhio).
Il Monocromatismo dei Coni Blu è caratterizzato da una serie di sintomi:
- Bassa acuità visiva, compresa tra 20/60 e 20/200.
- Scarsa discriminazione dei colori (ridotta capacità o incapacità di distinguere i colori).
- Intolleranza alla luce (caratterizzata dalla difficoltà di vedere in piena luce, soprattutto durante il giorno) e associata a fotofobia (sensibilità alla luce).
- Miopia, i pazienti spesso presentano miopia.
- Nistagmo (caratterizzato da movimenti involontari e ritmici degli occhi), presente fin dall’età di 2 mesi e che può diminuire con l’età.
Nella maggior parte dei soggetti affetti da Monocromatismo dei Coni Blu, i sintomi sono solitamente stazionari. Tuttavia, gli studi clinici mostrano prove di progressione della malattia con cambiamenti maculari [6,34,52].
Un bambino ipovedente, costretto a leggere un libro molto da vicino
Sinonimi
- Monocromia dei coni blu;
- Monocromia dei coni S;
- Acromatopsia atipica legata al cromosoma X;
- Acromatopsia incompleta legata al cromosoma X.
Cause: geni e mutazioni
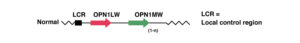
I geni coinvolti nel Monocromatismo dei Coni Blu sono tre e sono localizzati alla posizione Xq28, all’estremità del braccio q del cromosoma X. I tre geni sono in tandem e sono:
- LCR (Locus Control Region)
- OPN1LW (gene che codifica la proteina opsin dei coni L, rossi)
- OPN1MW (gene che codifica la proteina dei coni M, verdi)
Questi geni codificano le proteine necessarie nel processo di conversione della luce in segnali elettrici che il cervello utilizza per l’elaborazione visiva. Le proteine sono chiamate opsine dei coni L e dei coni M e svolgono un ruolo cruciale in questo processo.
La Locus Control Region (LCR) funge da promotore per l’espressione di due geni successivi, OPN1LW e OPN1MW, che codificano le proteine opsin responsabili della cattura della luce rossa e verde nella retina umana. La LCR assicura l’espressione esclusiva di un gene dell’opsina in ciascun cono [49,54,55].
Esistono numerose mutazioni genetiche che possono interessare questo gruppo di geni e portare alla BCM [9,17,25,26,28,38,39]: una deletion dell’LCR, la deletion intragenica di esoni all’interno dei geni OPN1LW e OPN1MW e un meccanismo a 2 steps con ricombinazione omologa e inattivazione.

Immagine tratta dai dati aggregati del Registro dei pazienti [1] disponibile su www.BCMRegistry.org.
Come si trasmette?
Il Monocromatismo dei Coni Blu si trasmette geneticamente attraverso i geni che passano dai genitori ai figli.
In particolare, la BCM è una malattia recessiva legata al cromosoma X, il che significa che la malattia si manifesta nei maschi (XY) che sono emizigoti per la mutazione e nelle rare femmine (XX) che sono omozigoti per la mutazione genetica, ovvero nelle femmine che hanno la mutazione genetica su entrambi i cromosomi X. Non è quindi impossibile che una femmina (XX) abbia la BCM, ma si tratta di una condizione estremamente rara.
Diagnosi
In un bambino di sesso maschile, a partire dai 2 mesi, l’avversione alla luce e il nistagmo possono far sospettare un caso di Moncromatismo dei Coni Blu, ma non forniscono indicazioni sufficienti per stabilire la forma della condizione. Per identificare un caso di Moncromatismo dei Coni Blu è necessario ricostruire la storia familiare, con la condizione legata alla trasmissione del cromosoma X, se ci sono altri casi in famiglia. Negli individui adulti è possibile testare l’acuità visiva e la visione dei colori e formulare una diagnosi clinica. Tuttavia, il passo più importante è la conferma genetica attraverso un test del DNA.
Gli strumenti diagnostici più adatti sono:
- Un test del DNA.
- Un test del colore, come il test Farnsworth D-15 o il test Farnsworth Munsell 100 Hue.
- La ricostruzione della storia familiare o Pedigree familiare della malattia.
- L’elettroretinogramma (ERG), che può dimostrare la perdita delle funzioni dei coni L/M con il conseguente mantenimento della funzione dei coni S e dei bastoncelli [4].
È importante considerare la diagnosi differenziali distinguendo la BCM da altre malattie che si presentano con caratteristiche cliniche simili, ad esempio l’acromatopsia [7]. È fondamentale giungere a una diagnosi corretta perché l’evoluzione della malattia, le possibili terapie e gli ausili necessari cambiano a seconda della condizione specifica. Il passo fondamentale per confermare la diagnosi di Monocromatismo dei Coni Blu è il test del DNA.
Terapia Genica e trattamenti
Ad oggi, non esiste una cura conosciuta per il Monocromatismo dei Coni Blu; tuttavia, sono attualmente in corso di valutazione l’efficacia e la sicurezza di diversi potenziali trattamenti, tra i quali il più promettente è la terapia genica.
L’obiettivo degli studi di terapia genica [15,16,23,51,59,61,62] è quello di inserire mediante un vettore virale AAV entro le cellule retiniche che esprimono geni mutanti associati al fenotipo del Monocromatismo dei Coni Blu, il gene sano OPN1LW, consentendo così la riparazione e il corretto funzionamento delle cellule dei fotorecettori retinici in risposta alle istruzioni associate al gene sano inserito.
Inoltre, gli ausili visivi correttivi e la terapia visiva personalizzata fornita dai Low Vision Specialists (specialisti dell’ipovisione) possono aiutare i pazienti a proteggere la retina dalla luce e ad ottimizzare l’acuità visiva residua.
Epidemiologia
Il Monocromatismo dei Coni Blu è una condizione di ipovisione ereditaria che, secondo le stime, colpisce circa 1 persona su 100.000 [27]. La malattia colpisce i maschi XY che ricevono la mutazione legata al cromosoma X, mentre le femmine XX rimangono generalmente portatrici non affette.
Storia
Le prime scoperte
Il Monocromatismo dei Coni Blu è noto da molti anni: la prima descrizione dettagliata risale a Huddart nel 1777 [24], il quale riconobbe che gli individui affetti da Monocromatismo dei Coni Blu avevano difficoltà a distinguere i colori, ma erano in grado di distinguere tra il bianco, il nero e vari colori chiari o luminosi.
Studi successivi sul Monocromatismo dei Coni Blu furono condotti da Sloan nel 1954 [48] e da Blackwell e Blackwell nel 1961 [8], che descrissero pazienti in grado di distinguere tra segnali blu e gialli, che sembravano avere bastoncelli e cellule S funzionali. Inoltre, Spivey nel 1965 [50] osservò che gli individui affetti erano in grado di vedere piccoli oggetti blu su un grande campo giallo e viceversa.
La malattia è stata studiata anche da Alpern et al. (1960) [2,3] e da Fleischman (1981), ma i risultati più importanti sono stati ottenuti nel 1989 e nel 1993 da Nathans et al. [38,39] e nel 1991 da Reyniers et al. [46] che hanno identificato i geni che causano il Monocromatismo dei Coni Blu.
Studi recenti
Solo negli ultimi anni, grazie al sostegno della BCM Families Foundation, il Monocromatismo dei Coni Blu è stato studiato con l’obiettivo di trovare una cura.
In particolare, dal 2010 la BCM Families Foundation finanzia studi clinici presso l’Università della Pennsylvania con l’obiettivo di capire se la terapia genica possa essere un trattamento per il Monocromatismo dei Coni Blu. Risultati positivi, mai ottenuti prima, dimostrano la presenza di un numero di cellule coniche nella retina sufficiente a giustificare la terapia genica [11]. Queste cellule fotorecettrici coniche possono essere trattate con la terapia genica. Un altro studio ha confrontato i pazienti appartenenti alle due principali mutazioni causative del Monocromatismo dei Coni Blu, le deletions e le mutazioni missense C203R, e ha identificato le finestre di età in cui è possibile intervenire con la terapia genica [52]. Questa serie di ricerche rappresenta uno studio di storia naturale del Monocromatismo dei Coni Blu. Ulteriori ricerche hanno portato all’identificazione di misure di esito per uno studio clinico e all’identificazione di criteri di inclusione ed esclusione [12,30,33,47,51].
Con il sostegno finanziario e/o la collaborazione della BCM Families Foundation, sono stati condotti diversi studi sui vettori di terapia genica. Il gruppo del Dr. W.W. Hauswirth dell’Università della Florida prima e il gruppo del Dr. Wen Tao Deng della West Virginia University poi, hanno lavorato su modelli animali di Monocromatismo dei Coni Blu per identificare il miglior vettore AAV per la terapia genica [15,16,18,23,59,61,62]. Adverum Biotechnologies. Inc, ha valutato un nuovo vettore AAV intravitreale per terapia genica per il Monocromatismo dei Coni Blu [23]. ADVM-062 è infatti un vettore ottimizzato per l’espressione specifica della proteina opsin L umana. A differenza delle terapie esistenti che prevedono l’iniezione sottoretinica del vettore, ADVM-062 può essere somministrato con una singola iniezione intravitreale (IVT), che comporta meno rischi per la struttura retinica centrale dei pazienti affetti dal Monocromatismo dei Coni Blu.
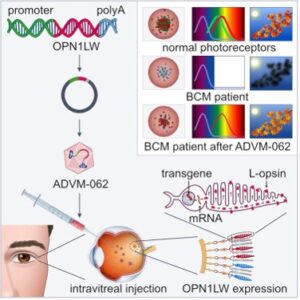
Immagine tratta dal rif. [23]
Diversi studi scientifici recenti sono stati condotti sul Monocromatismo dei Coni Blu [9,17,25,26,28, 38,39,46,58] per identificare tutte le mutazioni causative e per comprendere a fondo le principali. Le tecnologie di sequenziamento di nuova generazione (NGS) del DNA sono state introdotte nei laboratori e consentono di sequenziare l’intero esoma o l’intero genoma. Queste tecnologie rappresentano il futuro dei test sul DNA, in quanto offrono la possibilità di sequenziare un intero esoma o genoma in pochi giorni e a costi ragionevoli, consentendo di individuare malattie genetiche che altrimenti non sarebbero state individuate. Tuttavia, il sequenziamento di nuova generazione (NGS) a lettura breve, ampiamente utilizzato, non è adatto per l’analisi del cluster genico OPN1LW/OPN1MW del Monocromatismo dei Coni Blu e recentemente è stato sviluppato un nuovo strumento [22].
Video
1. Video prodotto dai Low Vision Centers of Indiana, che mostra i sintomi del Monocromatismo dei Coni Blu e l’uso di lenti a contatto con filtro magenta:
2. Video di nistagmo in un bambino di 4 mesi affetto da Monocromatismo dei Coni Blu:
Risorse Esterne
- The BCM Patient Registry
- OMIM page for Blue Cone Monochromacy – L’Online Mendelian Inheritance in Man (OMIM) è un catalogo online dei geni e dei disturbi genetici umani sviluppato e gestito dal McKusick-Nathans Institute of Genetic Medicine della Johns Hopkins University.
- Orphanet – Orphanet è un database europeo e un portale web che fornisce informazioni sulle malattie rare per promuovere la ricerca e la collaborazione nel settore.
- University of Tübingen, Germany project on Blue Cone Monochromacy
- A Colorful Cure: How Gene Therapy Is Treating Blue Cone Monochromacy (Forbes, 2023)
- info – Journey through the Light
- Kohl, S., Hamel, C. Clinical utility gene card for: blue cone monochromatism. Eur J Hum Genet19, 732 (2011)
- National Center for Advancing Translational Sciences
- The University of Arizona Health Sciences’ page for Blue Cone Monochromacy
- Fighting Blindness’ page for Blue Cone Monochromacy
Citazioni:
- “Patient Registry – Blue Cone Monochromacy”.
- Alpern M, Lee G B, Maaseidvaag F, Miller SS, (1971). “Colour vision in blue cone ‘monochromacy'”. J. Physiol. 212 (1): 211–33. doi:1113/jphysiol.1971.sp009318.
- Alpern M, Falls H F, Lee G B, (1960). “The enigma of typical total monochromacy”. J. Ophthalmol. 50 (5): 996–1012. doi:10.1016/0002-9394(60)90353-6. PMID13682677.
- Andréasson, S; Tornqvist, K (1991). “Electroretinograms in patients with achromatopsia”. Acta Ophthal. (Copenh) 69 (6): 711-716. PMID 1789084. https://doi.org/10.1111/j.1755-3768.1991.tb02048.x
- Ayyagari R, Kakuk L E, Bingham E L, Szczesny J J, Kemp J, Toda Y, Felius J, Sieving P A, (2000). “Spectrum of color gene deletions and phenotype in patients with blue cone monochromacy” Genet. 107 (1): 75–82. doi:10.1007/s004390000338.
- Ayyagari R, Kakuk L E, Coats C L, Bingham EL, Toda Y, Felius J, Sieving P A, (1999).”Bilateral macular atrophy in blue cone monochromacy (BCM) with loss of the locus control region (LCR) and part of the red pigment gene”. Vis. 28: 5-13. PMID 10427103.
- Berson EL, Sandberg MA, Rosner B, Sullivan PL, (1983). “Color plates to help identify patients with blue cone monochromatism”. J. Ophthalmol. 95 (6): 741–7. doi:10.1016/0002-9394(83)90058-2. PMID6602551.
- Blackwell H R, Blackwell O M, (1961). “Rod and cone receptor mechanisms in typical and atypical congenital achromatopsia”. Vision Res. 1 (1–2): 62–107. doi:1016/0042-6989(61)90022-0.
- Buena-Atienza E, Nasser F, Kohl S, Wissinger B, (2018) “A 73,128 bp de novo deletion encompassing the OPN1LW/OPN1MW gene cluster in sporadic Blue Cone Monochromacy: A case report.” BMC Med. Genet. 19, 107 (2018). – DOI: 1186/s12881-018-0623-8
- Carroll J, et al. (2010) “Deletion of the X-linked opsin gene array locus control region (LCR) results in disruption of the cone mosaic” Vision Res. 50, 1989–1999 (2010). – doi: 1016/j.visres.2010.07.009
- Cideciyan A V, Hufnagel R B, Carroll J, Sumaroka A, Luo X, Schwartz S B, Dubra A, Land M, Michaelides M, Gardner J C, Hardcastle A J, Moore A T, Sisk R A, Ahmed Z M, Kohl S, Wissinger B, Jacobson S G, (2013) “Human cone visual pigment deletions spare sufficient photoreceptors to warrant gene therapy”. Hum Gene Ther 2013; 24: 993-1006. – DOI: 1089/hum.2013.153
- Cideciyan A V, Roman A J, Jacobson S G, Yan B, Pascolini M, Charng J, Pajaro S, Nirenberg S, (2016) “Developing an outcome measure with high luminance for optogenetics treatment of severe retinal degenerations and for gene therapy of cone diseases”. Invest Ophthalmol Vis Sci. 57(7):3211-21. DOI: 1167/iovs.16-19586
- Crognale M A, Fry M, Highsmith J, Haegerstrom-Portnoy G, Neitz M, Neitz J, Webster M A, (2004). “Characterization of a novel form of X-linked incomplete achromatopsia”. Neurosci. 21 (3): 197-203. DOI: 10.1017/s0952523804213384
- Deeb S S, (2005). “The molecular basis of variation in human color vision”. Genet. 67 (5): 369-377. DOI: 10.1111/j.1399-0004.2004.00343.x
- Deng WT, Li J, Zhu P, Chiodo V A, Smith W C, Freedman B, Baehr W, Pang J, Hauswirth W W. (2018) ‘Human L- and M-opsins restore M-cone function in a mouse model for human blue cone monochromacy’. Molecular Vision (2018) 24, 17-28. PMID: 29386880.
- Deng WT, Li J, Zhu P, Freedman B, Smith W C, Baehr W, Hauswirth W W, (2019) “Rescue of M-cone Function in Aged Opn1mw−/− Mice, a Model for Late-Stage Blue Cone Monochromacy”. Investigative Ophthalmology & Visual Science August (2019) Vol.60, 3644-3651. PMID: 31469404.
- Buena-Atienza E, Rüther K, Baumann B et al. (2016) “De novo intrachromosomal gene conversion from OPN1MW to OPN1LW in the male germline results in Blue Cone Monochromacy”. Sci Rep 6, 28253 (2016). DOI: 10.1038/srep28253.
- Emily R. Sechrest, Kathryn Chmelik, Wendy D. Tan, Wen-Tao Deng, (2023) “Blue cone monochromacy and gene therapy” Vision Research,Volume 208,2023,108221,ISSN 0042-6989, – DOI: 1016/j.visres.2023.108221
- Gardner J C, Liew G, Quan Y H, Ermetal B, Ueyama H, Davidson A E, Schwarz N, Kanuga N, Chana R, Maher E, Webster A R, Holder G E, Robson A G, Cheetham, M E, Liebelt J, Ruddle J B, Moore A T, Michaelides M, Hardcastle A J, (2014). “A three different cone opsin gene array mutational mechanisms with genotype-phenotype correlation and functional investigation of cone opsin variants”. Mutat. 35 (11): 1354-1362. DOI: 10.1002/humu.22679
- Gardner J C, Webb T R, Kanuga N, Robson A G, Holder G E, Stockman A, Ripamonti C, Ebenezer N D, Ogun O, Devery S, Wright G A, Maher E R, Cheetham M E, Moore A T, Michaelides M, Hardcastle A J, (2010). “X-Linked Cone Dystrophy Caused by Mutation of the Red and Green Cone Opsins”. J. Hum. Genet. 87 (1): 26–39. doi:10.1016/j.ajhg.2010.05.019.
- Gardner J C, Michaelides M, Holder G E, Kanuga N, Webb T R, Mollon J D, Moore A T, Hardcastle A J, (2009). “Blue cone monochromacy: Causative mutations and associated phenotypes”. Molecular Vision. 15: 876–884. PMC2676201. PMID 19421413.
- Haer-Wigman L, den Ouden A, van Genderen MM, Kroes HY, Verheij J, Smailhodzic D, Hoekstra AS, Vijzelaar R, Blom J, Derks R, Tjon-Pon-Fong M, Yntema HG, Nelen MR, Vissers LELM, Lugtenberg D, Neveling K. (2022) “Diagnostic analysis of the highly complex OPN1LW/OPN1MW gene cluster using long-read sequencing and MLPA.” NPJ Genom Med. 2022 Nov 9;7(1):65. doi: 10.1038/s41525-022-00334-9.
- Hanna K, Nieves J, Dowd C, Bender K O, Sharma P, Singh B, Renz M, Ver Hoeve J N, Cepeda D, Gelfman C M, Riley B E, Grishanin R N, (2023) “Preclinical evaluation of ADVM-062, a novel intravitreal gene therapy vector for the treatment of blue cone monochromacy”. Mol Ther. 2023 Jul 5;31(7):2014-2027. doi: 10.1016/j.ymthe.2023.03.011.
- Huddart, J (1777). “An account of persons who could not distinguish colours”. Trans. R. Soc. 67: 260. doi:10.1098/rstl.1777.0015. S2CID186212155.
- Katagiri S., et al. , (2018) “Genotype determination of the OPN1LW/OPN1MW genes: Novel disease-causing mechanisms in Japanese patients with blue cone monochromacy”. Rep. 8, 11507 (2018). DOI: 10.1038/s41598-018-29891-9
- Keller U, Wissinger B, Tippmann S, Kohl S, Kraus H, Foerster M H, (2004). “Blue cone monochromatism: clinical findings in patients with mutations in the red/green opsin gene cluster”. Graefes Arch. Clin. Exp. Ophthalmol. 242 (9): 729-735. DOI: 1007/s00417-004-0921-z .
- Kohl S, Hamel C P, (2011). “Clinical utility gene card for: blue cone monochromatism”. Eur. J. Hum. 19 (6): 732. doi:10.1038/ejhg.2010.232.
- Ladekjaer-Mikkelsen, A S; Rosenberg, T; Jørgensen, A L (1996). “A new mechanism in blue cone monochromatism”. Genet. 98 (4): 403–408. doi:10.1007/s004390050229.
- Lewis R A, Holcomb J D, Bromley W C, Wilson M C, Roderick T H, Hejtmancik J F, (1987). “Mapping X-linked ophthalmic diseases: III. Provisional assignment of the locus for blue cone monochromacy to Xq28”. Ophthalmol. 105 (8): 1055-1059. DOI: 10.1001/archopht.1987.01060080057028
- Luo X, Cideciyan A V, Iannaccone A, Roman A J, Ditta L C, Jennings B J, Yatsenko S, Sheplock R, Sumaroka A, Swider M, Schwartz S B, Wissinger B, Kohl S, Jacobson S G, (2015). “Blue cone monochromacy: visual function and efficacy outcome measures for clinical trials”. PLOS ONE. 10 (4): e0125700 doi:1371/journal.pone.0125700.
- Mancuso K, Hauswirth W W, Li Q, Connor T B, Kuchenbecker J A, Mauck M C, Neitz J, Neitz M, (2009) “Gene therapy for red-green colour blindness in adult primates”. Nature (2009) 461:784-787. PMID: 19759534.
- Mancuso K, Mauck M C, Kuchenbecker J A, Neitz M, and Neitz J, (2010) “A Multi-Stage Color Model Revisited: Implications for a Gene Therapy Cure for Red-Green Colorblindness’2 (2010) R.E. Anderson et al. (eds.), Retinal Degenerative Diseases, Advances in Experimental Medicine and Biology 664. PMID: 20238067.
- Mascio A A, Roman A J, Cideciyan A V, Sheplock R, Wu V, Garafalo A V, Sumaroka A, Pirkle S, Kohl S, Wissinger B, Jacobson S G and Barbur J L, (2023) “Color vision in blue cone monochromacy: outcome measures for a clinical trial” Transl Vis Sci Techno 2023 Jan 3;12(1):25 DOI: 1167/tvst.12.1.25
- Michaelides M, Johnson S, Simunovic M P, Bradshaw K, Holder G, Mollon J D, Moore A T, Hunt D M, (2005). “Blue cone monochromatism: a phenotype and genotype assessment with evidence of progressive loss of cone function in older individuals”. Eye (Lond). 19 (1): 2–10. doi:1038/sj.eye.6701391. PMID15094734.
- Mizrahi-Meissonnier L, Merin S, Banin E, Sharon D, (2010). “Variable Retinal Phenotypes caused by mutations in the X-linked phopigment gene array”. Ophthal. Vis. Sci. 51 (8): 3884-92. PMID 20220053.
- Nathans, J (1987). “Molecular biology of visual pigments”. Rev. Neurosci 10: 163-194. PMID 3551758.
- Nathans, J (1999). “The evolution and physiology of human color vision: insights from molecular genetic studies of visual pigments”. 24 (2): 299-312. PMID 10571225
- Nathans, J; Davenport, C M; Maumenee, I H; Lewis, R A; Hejtmancik, J F; Litt, M; Lovrien, E; Weleber, R; Bachynski, B; Zwas, F; Klingaman, R; Fishman, G (1989). “Molecular genetics of human blue cone monochromacy”. Science. 245 (4920): 831–838. doi:1126/science.2788922.
- Nathans J, Maumenee I H, Zrenner E, Sadowski B, Sharpe L T, Lewis R A, Hansen E, Rosenberg T, Schwartz M, Heckenlively J R, Trabulsi E, Klingaman R, Bech-Hansen N T, LaRoche G R, Pagon R A, Murphey W H, Weleber R G, (1993). “Genetic heterogeneity among blue cone monochromats”. Am. J. Hum. Genet. 53 (5): 987–1000. PMC1682301. PMID 8213841.
- Nathans J, Piantanida T P, Eddy R L, Shows T B, Hogness D S, (1986). “Molecular genetics of inherited variation in human color vision”. Science 232 (4747): 203-210. PMID 3485310.
- Nathans J, Thomas D, Hogness D S, (1986). “Molecular genetics of human color vision: the genes encoding blue, green, and red pigments”. Science 232 (4747): 193-202. PMID 2937147
- Neitz J, Neitz M, (2011). “The genetics of normal and defective color vision”. Vision Res. 51 (7): 633–651. doi:1016/j.visres.2010.12.002.
- Neitz M, (2000). “Molecular Genetics of Color Vision and Color Vision Defects”. Archives of Ophthalmology. 118 (5): 691–700. doi:1001/archopht.118.5.691.
- Pinckers A, (1992) “Berson test for blue cone monochromatism”. Ophthalmol. 16 (3):185-186. PMID 1452423.
- Reitner A, Sharpe L T, Zrenner E, (1991). “Is colour vision possible with only rods and Blue sensitive cones?”. 352 (6338): 798–800. Bibcode:1991Natur.352..798R. doi:10.1038/352798a0. PMID1881435. S2CID 4328439.
- Reyniers E, et al. , (1995) “Gene conversion between red and defective green opsin gene in blue cone monochromacy”. Genomics 29, 323–328 (1995). – PubMed
- Semenov E P, Sheplock R, Roman A J, McGuigan D B, Swider M, Cideciyan A V, Jacobson S G, (2022) “Reading performance in blue cone monochromacy: defining an outcome measure for a clinical trial.” Transl Vis Sci Technol. 2020 Dec 8;9(13):13. – doi: 1167/tvst.9.13.13
- Sloan L L, Newhall S M, (1942). “Comparison of cases of atypical and typical achromatopsia”. American Journal of Ophthalmology. 25 (8): 945–961. doi:1016/S0002-9394(42)90594-4.
- Smallwood P M, Wang Y, Nathans J, (2002) “Role of a locus control region in the mutually exclusive expression of human red and green cone pigment genes”. Natl. Acad. Sci. U.S.A. 99, 1008–1011 (2002). – PMC – PubMed
- Spivey B E, (1965) “The X-linked recessive inheritance of atypical monochromatism”. Ophthalmol. 74 (3): 327–333. doi:10.1001/archopht.1965.00970040329007.
- Sumaroka A, Cideciyan AV, Sheplock R, Wu V, Kohl S, Wissinger B, Jacobson SG, (2020) “Foveal therapy in blue cone monochromacy: predictions of visual potential from artificial intelligence”. Front Neurosci. 2020 Aug 3;14:800. doi: 10.3389/fnins.2020.00800.
- Sumaroka A, Garafalo AV, Cideciyan AV, Charng J, Roman AJ, Choi W, Saxena S, Aksianiuk V, Kohl S, Wissinger B, Jacobson SG. (2018) “Blue cone monochromacy caused by the C203R missense mutation or large deletion mutations”. Invest Ophthalmol Vis Sci. 2018 Dec 3;59(15):5762-72. doi:https://doi.org/10.1167/iovs.18-25280
- Wang C., et al. , Novel OPN1LW/OPN1MW deletion mutations in 2 Japanese families with blue cone monochromacy. Genome Var. 3, 16011 (2016). – PMC – PubMed
- Wang Y., et al. , A locus control region adjacent to the human red and green visual pigment genes. Neuron 9, 429–440 (1992). – PubMed
- Wang, Y; Macke, J P; Merbs, S L; Zack, D J; Klaunberg, B; Bennett, J; Gearhart, J; Nathans, J (1992). “A locus control region adjacent to the human red and green visual pigment genes”. 9 (3): 429-440. PMID 1524826.
- Weale, RA (1953). “Cone Monochromatism”. The Journal of Physiology. 121 (3): 548–569. doi:1113/jphysiol.1953.sp004964.
- Winderickx J, Sanocki E, Lindsey DT, Teller DY, Motulsky AG, Deeb SS, (1992). “Defective colour vision associated with a missense mutation in the human green visual pigment gene”. Genet. 1 (4): 251–6. doi:10.1038/ng0792-251.
- Wissinger B, Baumann B, Buena-Atienza E, Ravesh Z, Cideciyan AV, Stingl K, Audo I, Meunier I, Bocquet B, Traboulsi EI, Hardcastle AJ, Gardner JC, Michaelides M, Branham KE, Rosenberg T, Andreasson S, Dollfus H, Birch D, Vincent AL, Martorell L, Català Mora J, Kellner U, Rüther K, Lorenz B, Preising MN, Manfredini E, Zarate YA, Vijzelaar R, Zrenner E, Jacobson SG, Kohl S, (2022) “The landscape of submicroscopic structural variants at the OPN1LW/OPN1MW gene cluster on Xq28 underlying blue cone monochromacy”. Proc Natl Acad Sci U S A. 2022 Jul 5;119(27):e2115538119. doi: 10.1073/pnas.2115538119.
- Xie B, Nakanishi S, Guo Q, Xia F, Yan G, An J, Li L, Serikawa T, Kuramoto T, Zhang Z. (2010) ”A novel middle-wavelength opsin (M-opsin) null-mutation in the retinal cone dysfunction rat”. Eye Res. (2010) 91 (1):26-33. PMID: 20371244.
- Yatsenko S. A., et al. , “High-resolution microarray analysis unravels complex Xq28 aberrations in patients and carriers affected by X-linked blue cone monochromacy”. Genet. 89, 82–87 (2016). – PMC – PubMed
- Zhang Z, Pang J, Xia F, Guo Q, Li L, An J, Zhang L, Hauswirth W W, Yang S, Li Z. “AAV-mediated Gene Therapy Restores Cone Function In A Rat With An M-cone Opsin Deficiency. A Model For Blue Cone Monochromacy”. PMID: 29386880.
- Zhang Y, Deng W T, Du W, Zhu P, Li J, Xu F, Sun J, Gerstner C D, Baehr W, Boye Sanford L, Zhao C, Hauswirth W W, Pang J, (2017) “Gene-based Therapy in a Mouse Model of Blue Cone Monochromacy”. Sci Rep 7, 6690 (2017). https://doi.org/10.1038/s41598-017-06982-7
Che cos’è il Monocromatismo dei Coni Blu?
Il Monocromatismo dei Coni Blu (Blue Cone Monochromacy o BCM) è una malattia genetica rara della retina che si stima colpisca una persona su 100.000.
Si tratta di una degenerazione retinica ereditaria (IRD) causata da mutazioni nel gruppo di geni OPN1LW/OPN1MW, che codificano le proteine opsin sensibili alle lunghezze d’onda lunga (L) e media (M) (ovvero, rossa e verde) [38,39,41] dei fotorecettori della retina, i coni.
Le disabilità visive sono significative e comprendono una ridotta acuità visiva, visione anormale dei colori, miopia, nistagmo e fotofobia [11,20,21,34,52].
Il Monocromatismo dei Coni Blu colpisce la retina, sul retro dell’occhio
È una malattia recessiva legata al cromosoma X, di conseguenza colpisce quasi esclusivamente i maschi (XY) mentre le femmine portatrici (XX) solo raramente mostrano alcuni dei sintomi, in forma lieve.
Il Monocromatismo dei Coni Blu è solitamente considerato una malattia stazionaria i cui sintomi si manifestano per la prima volta durante l’infanzia, anche se esistono dei dati che indicano una progressione della malattia con cambiamenti maculari associati alla degenerazione maculare in molti pazienti [5, 6 ,34,52]. Il primo sintomo osservato è il nistagmo nei neonati di 2-3 mesi.
Il video che mostra il nistagmo in un bambino di 4 mesi affetto da Monocromatismo dei Coni Blu
Sintomi
Nella retina umana sono presenti tre tipi di coni, responsabili della visione diurna, dell’acuità visiva e della visione dei colori: sono sensibili alla luce di lunghezza d’onda Lunga (rosso), Media (verde) e corta o Short (blu) [41]. Quando le persone sono affette da Monocromatismo dei Coni Blu, sia i coni rossi che quelli verdi non funzionano correttamente, mentre i coni blu funzionano regolarmente [5,38,39]. I sintomi possono includere bassa acuità visiva (chiarezza o nitidezza), alterazione della visione dei colori, fotofobia (sensibilità alla luce), miopia (difficoltà a mettere a fuoco gli oggetti lontani) e nistagmo (movimenti rapidi e incontrollabili dell’occhio).
Il Monocromatismo dei Coni Blu è caratterizzato da una serie di sintomi:
- Bassa acuità visiva, compresa tra 20/60 e 20/200.
- Scarsa discriminazione dei colori (ridotta capacità o incapacità di distinguere i colori).
- Emeralopia (caratterizzata dalla difficoltà di vedere in piena luce, soprattutto durante il giorno) e associata a fotofobia (sensibilità alla luce).
- Miopia, i pazienti spesso presentano miopia.
- Nistagmo (caratterizzato da movimenti involontari e ritmici degli occhi), presente fin dall’età di 2 mesi e che può diminuire con l’età.
Nella maggior parte dei soggetti affetti da Monocromatismo dei Coni Blu, i sintomi sono solitamente stazionari. Tuttavia, gli studi clinici mostrano prove di progressione della malattia con cambiamenti maculari [6,34,52].
Un bambino ipovedente, costretto a leggere un libro molto da vicino
Sinonimi
- Monocromia dei coni blu;
- Monocromia dei coni S;
- Acromatopsia atipica legata al cromosoma X;
- Acromatopsia incompleta legata al cromosoma X.
Cause: geni e mutazioni
I geni coinvolti nel Monocromatismo dei Coni Blu sono tre e sono localizzati alla posizione Xq28, all’estremità del braccio q del cromosoma X. I tre geni sono in tandem e sono:
- LCR (Locus Control Region)
- OPN1LW (gene che codifica la proteina opsin dei coni L, rossi)
- OPN1MW (gene che codifica la proteina dei coni M, verdi)

Questi geni codificano le proteine necessarie nel processo di conversione della luce in segnali elettrici che il cervello utilizza per l’elaborazione visiva. Le proteine sono chiamate opsine dei coni L e dei coni M e svolgono un ruolo cruciale in questo processo.
La Locus Control Region (LCR) funge da promotore per l’espressione di due geni successivi, OPN1LW e OPN1MW, che codificano le proteine opsin responsabili della cattura della luce rossa e verde nella retina umana. La LCR assicura l’espressione esclusiva di un gene dell’opsina in ciascun cono [49,54,55].
Esistono numerose mutazioni genetiche che possono interessare questo gruppo di geni e portare alla BCM [9,17,25,26,28,38,39]: una deletion dell’LCR, la deletion intragenica di esoni all’interno dei geni OPN1LW e OPN1MW e un meccanismo a 2 steps con ricombinazione omologa e inattivazione.

Immagine tratta dai dati aggregati del Registro dei pazienti [1] disponibile su www.BCMRegistry.org.
Come si trasmette?
Il Monocromatismo dei Coni Blu si trasmette geneticamente attraverso i geni che passano dai genitori ai figli.
In particolare, la BCM è una malattia recessiva legata al cromosoma X, il che significa che la malattia si manifesta nei maschi (XY) che sono emizigoti per la mutazione e nelle rare femmine (XX) che sono omozigoti per la mutazione genetica, ovvero nelle femmine che hanno la mutazione genetica su entrambi i cromosomi X. Non è quindi impossibile che una femmina (XX) abbia la BCM, ma si tratta di una condizione estremamente rara.
Diagnosi
In un bambino di sesso maschile, a partire dai 2 mesi, l’avversione alla luce e il nistagmo possono far sospettare un caso di Moncromatismo dei Coni Blu, ma non forniscono indicazioni sufficienti per stabilire la forma della condizione. Per identificare un caso di Moncromatismo dei Coni Blu è necessario ricostruire la storia familiare, con la condizione legata alla trasmissione del cromosoma X, se ci sono altri casi in famiglia. Negli individui adulti è possibile testare l’acuità visiva e la visione dei colori e formulare una diagnosi clinica. Tuttavia, il passo più importante è la conferma genetica attraverso un test del DNA.
Gli strumenti diagnostici più adatti sono:
- Un test del DNA.
- Un test del colore, come il test Farnsworth D-15 o il test Farnsworth Munsell 100 Hue.
- La ricostruzione della storia familiare o Pedigree familiare della malattia.
- L’elettroretinogramma (ERG), che può dimostrare la perdita delle funzioni dei coni L/M con il conseguente mantenimento della funzione dei coni S e dei bastoncelli [4].
È importante considerare la diagnosi differenziali distinguendo la BCM da altre malattie che si presentano con caratteristiche cliniche simili, ad esempio l’acromatopsia [7]. È fondamentale giungere a una diagnosi corretta perché l’evoluzione della malattia, le possibili terapie e gli ausili necessari cambiano a seconda della condizione specifica. Il passo fondamentale per confermare la diagnosi di Monocromatismo dei Coni Blu è il test del DNA.
Terapia Genica e trattamenti
Ad oggi, non esiste una cura conosciuta per il Monocromatismo dei Coni Blu; tuttavia, sono attualmente in corso di valutazione l’efficacia e la sicurezza di diversi potenziali trattamenti, tra i quali il più promettente è la terapia genica.
L’obiettivo degli studi di terapia genica [15,16,23,51,59,61,62] è quello di inserire mediante un vettore virale AAV entro le cellule retiniche che esprimono geni mutanti associati al fenotipo del Monocromatismo dei Coni Blu, il gene sano OPN1LW, consentendo così la riparazione e il corretto funzionamento delle cellule dei fotorecettori retinici in risposta alle istruzioni associate al gene sano inserito.
Inoltre, gli ausili visivi correttivi e la terapia visiva personalizzata fornita dai Low Vision Specialists (specialisti dell’ipovisione) possono aiutare i pazienti a proteggere la retina dalla luce e ad ottimizzare l’acuità visiva residua.
Epidemiologia
Il Monocromatismo dei Coni Blu è una condizione di ipovisione ereditaria che, secondo le stime, colpisce circa 1 persona su 100.000 [27]. La malattia colpisce i maschi XY che ricevono la mutazione legata al cromosoma X, mentre le femmine XX rimangono generalmente portatrici non affette.
Storia
Le prime scoperte
Il Monocromatismo dei Coni Blu è noto da molti anni: la prima descrizione dettagliata risale a Huddart nel 1777 [24], il quale riconobbe che gli individui affetti da Monocromatismo dei Coni Blu avevano difficoltà a distinguere i colori, ma erano in grado di distinguere tra il bianco, il nero e vari colori chiari o luminosi.
Studi successivi sul Monocromatismo dei Coni Blu furono condotti da Sloan nel 1954 [48] e da Blackwell e Blackwell nel 1961 [8], che descrissero pazienti in grado di distinguere tra segnali blu e gialli, che sembravano avere bastoncelli e cellule S funzionali. Inoltre, Spivey nel 1965 [50] osservò che gli individui affetti erano in grado di vedere piccoli oggetti blu su un grande campo giallo e viceversa.
La malattia è stata studiata anche da Alpern et al. (1960) [2,3] e da Fleischman (1981), ma i risultati più importanti sono stati ottenuti nel 1989 e nel 1993 da Nathans et al. [38,39] e nel 1991 da Reyniers et al. [46] che hanno identificato i geni che causano il Monocromatismo dei Coni Blu.
Studi recenti
Solo negli ultimi anni, grazie al sostegno della BCM Families Foundation, il Monocromatismo dei Coni Blu è stato studiato con l’obiettivo di trovare una cura.
In particolare, dal 2010 la BCM Families Foundation finanzia studi clinici presso l’Università della Pennsylvania con l’obiettivo di capire se la terapia genica possa essere un trattamento per il Monocromatismo dei Coni Blu. Risultati positivi, mai ottenuti prima, dimostrano la presenza di un numero di cellule coniche nella retina sufficiente a giustificare la terapia genica [11]. Queste cellule fotorecettrici coniche possono essere trattate con la terapia genica. Un altro studio ha confrontato i pazienti appartenenti alle due principali mutazioni causative del Monocromatismo dei Coni Blu, le deletions e le mutazioni missense C203R, e ha identificato le finestre di età in cui è possibile intervenire con la terapia genica [52]. Questa serie di ricerche rappresenta uno studio di storia naturale del Monocromatismo dei Coni Blu. Ulteriori ricerche hanno portato all’identificazione di misure di esito per uno studio clinico e all’identificazione di criteri di inclusione ed esclusione [12,30,33,47,51].
Con il sostegno finanziario e/o la collaborazione della BCM Families Foundation, sono stati condotti diversi studi sui vettori di terapia genica. Il gruppo del Dr. W.W. Hauswirth dell’Università della Florida prima e il gruppo del Dr. Wen Tao Deng della West Virginia University poi, hanno lavorato su modelli animali di Monocromatismo dei Coni Blu per identificare il miglior vettore AAV per la terapia genica [15,16,18,23,59,61,62]. Adverum Biotechnologies. Inc, ha valutato un nuovo vettore AAV intravitreale per terapia genica per il Monocromatismo dei Coni Blu [23]. ADVM-062 è infatti un vettore ottimizzato per l’espressione specifica della proteina opsin L umana. A differenza delle terapie esistenti che prevedono l’iniezione sottoretinica del vettore, ADVM-062 può essere somministrato con una singola iniezione intravitreale (IVT), che comporta meno rischi per la struttura retinica centrale dei pazienti affetti dal Monocromatismo dei Coni Blu.

Immagine tratta dal rif. [23]
Diversi studi scientifici recenti sono stati condotti sul Monocromatismo dei Coni Blu [9,17,25,26,28, 38,39,46,58] per identificare tutte le mutazioni causative e per comprendere a fondo le principali. Le tecnologie di sequenziamento di nuova generazione (NGS) del DNA sono state introdotte nei laboratori e consentono di sequenziare l’intero esoma o l’intero genoma. Queste tecnologie rappresentano il futuro dei test sul DNA, in quanto offrono la possibilità di sequenziare un intero esoma o genoma in pochi giorni e a costi ragionevoli, consentendo di individuare malattie genetiche che altrimenti non sarebbero state individuate. Tuttavia, il sequenziamento di nuova generazione (NGS) a lettura breve, ampiamente utilizzato, non è adatto per l’analisi del cluster genico OPN1LW/OPN1MW del Monocromatismo dei Coni Blu e recentemente è stato sviluppato un nuovo strumento [22].
Video
1. Video prodotto dai Low Vision Centers of Indiana, che mostra i sintomi del Monocromatismo dei Coni Blu e l’uso di lenti a contatto con filtro magenta:
2. Video di nistagmo in un bambino di 4 mesi affetto da Monocromatismo dei Coni Blu:
Risorse Esterne
- The BCM Patient Registry
- OMIM page for Blue Cone Monochromacy – L’Online Mendelian Inheritance in Man (OMIM) è un catalogo online dei geni e dei disturbi genetici umani sviluppato e gestito dal McKusick-Nathans Institute of Genetic Medicine della Johns Hopkins University.
- Orphanet – Orphanet è un database europeo e un portale web che fornisce informazioni sulle malattie rare per promuovere la ricerca e la collaborazione nel settore.
- University of Tübingen, Germany project on Blue Cone Monochromacy
- A Colorful Cure: How Gene Therapy Is Treating Blue Cone Monochromacy (Forbes, 2023)
- info – Journey through the Light
- Kohl, S., Hamel, C. Clinical utility gene card for: blue cone monochromatism. Eur J Hum Genet19, 732 (2011)
- National Center for Advancing Translational Sciences
- The University of Arizona Health Sciences’ page for Blue Cone Monochromacy
- Fighting Blindness’ page for Blue Cone Monochromacy
Citazioni:
- “Patient Registry – Blue Cone Monochromacy”.
- Alpern M, Lee G B, Maaseidvaag F, Miller SS, (1971). “Colour vision in blue cone ‘monochromacy'”. J. Physiol. 212 (1): 211–33. doi:1113/jphysiol.1971.sp009318.
- Alpern M, Falls H F, Lee G B, (1960). “The enigma of typical total monochromacy”. J. Ophthalmol. 50 (5): 996–1012. doi:10.1016/0002-9394(60)90353-6. PMID13682677.
- Andréasson, S; Tornqvist, K (1991). “Electroretinograms in patients with achromatopsia”. Acta Ophthal. (Copenh) 69 (6): 711-716. PMID 1789084. https://doi.org/10.1111/j.1755-3768.1991.tb02048.x
- Ayyagari R, Kakuk L E, Bingham E L, Szczesny J J, Kemp J, Toda Y, Felius J, Sieving P A, (2000). “Spectrum of color gene deletions and phenotype in patients with blue cone monochromacy” Genet. 107 (1): 75–82. doi:10.1007/s004390000338.
- Ayyagari R, Kakuk L E, Coats C L, Bingham EL, Toda Y, Felius J, Sieving P A, (1999).”Bilateral macular atrophy in blue cone monochromacy (BCM) with loss of the locus control region (LCR) and part of the red pigment gene”. Vis. 28: 5-13. PMID 10427103.
- Berson EL, Sandberg MA, Rosner B, Sullivan PL, (1983). “Color plates to help identify patients with blue cone monochromatism”. J. Ophthalmol. 95 (6): 741–7. doi:10.1016/0002-9394(83)90058-2. PMID6602551.
- Blackwell H R, Blackwell O M, (1961). “Rod and cone receptor mechanisms in typical and atypical congenital achromatopsia”. Vision Res. 1 (1–2): 62–107. doi:1016/0042-6989(61)90022-0.
- Buena-Atienza E, Nasser F, Kohl S, Wissinger B, (2018) “A 73,128 bp de novo deletion encompassing the OPN1LW/OPN1MW gene cluster in sporadic Blue Cone Monochromacy: A case report.” BMC Med. Genet. 19, 107 (2018). – DOI: 1186/s12881-018-0623-8
- Carroll J, et al. (2010) “Deletion of the X-linked opsin gene array locus control region (LCR) results in disruption of the cone mosaic” Vision Res. 50, 1989–1999 (2010). – doi: 1016/j.visres.2010.07.009
- Cideciyan A V, Hufnagel R B, Carroll J, Sumaroka A, Luo X, Schwartz S B, Dubra A, Land M, Michaelides M, Gardner J C, Hardcastle A J, Moore A T, Sisk R A, Ahmed Z M, Kohl S, Wissinger B, Jacobson S G, (2013) “Human cone visual pigment deletions spare sufficient photoreceptors to warrant gene therapy”. Hum Gene Ther 2013; 24: 993-1006. – DOI: 1089/hum.2013.153
- Cideciyan A V, Roman A J, Jacobson S G, Yan B, Pascolini M, Charng J, Pajaro S, Nirenberg S, (2016) “Developing an outcome measure with high luminance for optogenetics treatment of severe retinal degenerations and for gene therapy of cone diseases”. Invest Ophthalmol Vis Sci. 57(7):3211-21. DOI: 1167/iovs.16-19586
- Crognale M A, Fry M, Highsmith J, Haegerstrom-Portnoy G, Neitz M, Neitz J, Webster M A, (2004). “Characterization of a novel form of X-linked incomplete achromatopsia”. Neurosci. 21 (3): 197-203. DOI: 10.1017/s0952523804213384
- Deeb S S, (2005). “The molecular basis of variation in human color vision”. Genet. 67 (5): 369-377. DOI: 10.1111/j.1399-0004.2004.00343.x
- Deng WT, Li J, Zhu P, Chiodo V A, Smith W C, Freedman B, Baehr W, Pang J, Hauswirth W W. (2018) ‘Human L- and M-opsins restore M-cone function in a mouse model for human blue cone monochromacy’. Molecular Vision (2018) 24, 17-28. PMID: 29386880.
- Deng WT, Li J, Zhu P, Freedman B, Smith W C, Baehr W, Hauswirth W W, (2019) “Rescue of M-cone Function in Aged Opn1mw−/− Mice, a Model for Late-Stage Blue Cone Monochromacy”. Investigative Ophthalmology & Visual Science August (2019) Vol.60, 3644-3651. PMID: 31469404.
- Buena-Atienza E, Rüther K, Baumann B et al. (2016) “De novo intrachromosomal gene conversion from OPN1MW to OPN1LW in the male germline results in Blue Cone Monochromacy”. Sci Rep 6, 28253 (2016). DOI: 10.1038/srep28253.
- Emily R. Sechrest, Kathryn Chmelik, Wendy D. Tan, Wen-Tao Deng, (2023) “Blue cone monochromacy and gene therapy” Vision Research,Volume 208,2023,108221,ISSN 0042-6989, – DOI: 1016/j.visres.2023.108221
- Gardner J C, Liew G, Quan Y H, Ermetal B, Ueyama H, Davidson A E, Schwarz N, Kanuga N, Chana R, Maher E, Webster A R, Holder G E, Robson A G, Cheetham, M E, Liebelt J, Ruddle J B, Moore A T, Michaelides M, Hardcastle A J, (2014). “A three different cone opsin gene array mutational mechanisms with genotype-phenotype correlation and functional investigation of cone opsin variants”. Mutat. 35 (11): 1354-1362. DOI: 10.1002/humu.22679
- Gardner J C, Webb T R, Kanuga N, Robson A G, Holder G E, Stockman A, Ripamonti C, Ebenezer N D, Ogun O, Devery S, Wright G A, Maher E R, Cheetham M E, Moore A T, Michaelides M, Hardcastle A J, (2010). “X-Linked Cone Dystrophy Caused by Mutation of the Red and Green Cone Opsins”. J. Hum. Genet. 87 (1): 26–39. doi:10.1016/j.ajhg.2010.05.019.
- Gardner J C, Michaelides M, Holder G E, Kanuga N, Webb T R, Mollon J D, Moore A T, Hardcastle A J, (2009). “Blue cone monochromacy: Causative mutations and associated phenotypes”. Molecular Vision. 15: 876–884. PMC2676201. PMID 19421413.
- Haer-Wigman L, den Ouden A, van Genderen MM, Kroes HY, Verheij J, Smailhodzic D, Hoekstra AS, Vijzelaar R, Blom J, Derks R, Tjon-Pon-Fong M, Yntema HG, Nelen MR, Vissers LELM, Lugtenberg D, Neveling K. (2022) “Diagnostic analysis of the highly complex OPN1LW/OPN1MW gene cluster using long-read sequencing and MLPA.” NPJ Genom Med. 2022 Nov 9;7(1):65. doi: 10.1038/s41525-022-00334-9.
- Hanna K, Nieves J, Dowd C, Bender K O, Sharma P, Singh B, Renz M, Ver Hoeve J N, Cepeda D, Gelfman C M, Riley B E, Grishanin R N, (2023) “Preclinical evaluation of ADVM-062, a novel intravitreal gene therapy vector for the treatment of blue cone monochromacy”. Mol Ther. 2023 Jul 5;31(7):2014-2027. doi: 10.1016/j.ymthe.2023.03.011.
- Huddart, J (1777). “An account of persons who could not distinguish colours”. Trans. R. Soc. 67: 260. doi:10.1098/rstl.1777.0015. S2CID186212155.
- Katagiri S., et al. , (2018) “Genotype determination of the OPN1LW/OPN1MW genes: Novel disease-causing mechanisms in Japanese patients with blue cone monochromacy”. Rep. 8, 11507 (2018). DOI: 10.1038/s41598-018-29891-9
- Keller U, Wissinger B, Tippmann S, Kohl S, Kraus H, Foerster M H, (2004). “Blue cone monochromatism: clinical findings in patients with mutations in the red/green opsin gene cluster”. Graefes Arch. Clin. Exp. Ophthalmol. 242 (9): 729-735. DOI: 1007/s00417-004-0921-z .
- Kohl S, Hamel C P, (2011). “Clinical utility gene card for: blue cone monochromatism”. Eur. J. Hum. 19 (6): 732. doi:10.1038/ejhg.2010.232.
- Ladekjaer-Mikkelsen, A S; Rosenberg, T; Jørgensen, A L (1996). “A new mechanism in blue cone monochromatism”. Genet. 98 (4): 403–408. doi:10.1007/s004390050229.
- Lewis R A, Holcomb J D, Bromley W C, Wilson M C, Roderick T H, Hejtmancik J F, (1987). “Mapping X-linked ophthalmic diseases: III. Provisional assignment of the locus for blue cone monochromacy to Xq28”. Ophthalmol. 105 (8): 1055-1059. DOI: 10.1001/archopht.1987.01060080057028
- Luo X, Cideciyan A V, Iannaccone A, Roman A J, Ditta L C, Jennings B J, Yatsenko S, Sheplock R, Sumaroka A, Swider M, Schwartz S B, Wissinger B, Kohl S, Jacobson S G, (2015). “Blue cone monochromacy: visual function and efficacy outcome measures for clinical trials”. PLOS ONE. 10 (4): e0125700 doi:1371/journal.pone.0125700.
- Mancuso K, Hauswirth W W, Li Q, Connor T B, Kuchenbecker J A, Mauck M C, Neitz J, Neitz M, (2009) “Gene therapy for red-green colour blindness in adult primates”. Nature (2009) 461:784-787. PMID: 19759534.
- Mancuso K, Mauck M C, Kuchenbecker J A, Neitz M, and Neitz J, (2010) “A Multi-Stage Color Model Revisited: Implications for a Gene Therapy Cure for Red-Green Colorblindness’2 (2010) R.E. Anderson et al. (eds.), Retinal Degenerative Diseases, Advances in Experimental Medicine and Biology 664. PMID: 20238067.
- Mascio A A, Roman A J, Cideciyan A V, Sheplock R, Wu V, Garafalo A V, Sumaroka A, Pirkle S, Kohl S, Wissinger B, Jacobson S G and Barbur J L, (2023) “Color vision in blue cone monochromacy: outcome measures for a clinical trial” Transl Vis Sci Techno 2023 Jan 3;12(1):25 DOI: 1167/tvst.12.1.25
- Michaelides M, Johnson S, Simunovic M P, Bradshaw K, Holder G, Mollon J D, Moore A T, Hunt D M, (2005). “Blue cone monochromatism: a phenotype and genotype assessment with evidence of progressive loss of cone function in older individuals”. Eye (Lond). 19 (1): 2–10. doi:1038/sj.eye.6701391. PMID15094734.
- Mizrahi-Meissonnier L, Merin S, Banin E, Sharon D, (2010). “Variable Retinal Phenotypes caused by mutations in the X-linked phopigment gene array”. Ophthal. Vis. Sci. 51 (8): 3884-92. PMID 20220053.
- Nathans, J (1987). “Molecular biology of visual pigments”. Rev. Neurosci 10: 163-194. PMID 3551758.
- Nathans, J (1999). “The evolution and physiology of human color vision: insights from molecular genetic studies of visual pigments”. 24 (2): 299-312. PMID 10571225
- Nathans, J; Davenport, C M; Maumenee, I H; Lewis, R A; Hejtmancik, J F; Litt, M; Lovrien, E; Weleber, R; Bachynski, B; Zwas, F; Klingaman, R; Fishman, G (1989). “Molecular genetics of human blue cone monochromacy”. Science. 245 (4920): 831–838. doi:1126/science.2788922.
- Nathans J, Maumenee I H, Zrenner E, Sadowski B, Sharpe L T, Lewis R A, Hansen E, Rosenberg T, Schwartz M, Heckenlively J R, Trabulsi E, Klingaman R, Bech-Hansen N T, LaRoche G R, Pagon R A, Murphey W H, Weleber R G, (1993). “Genetic heterogeneity among blue cone monochromats”. Am. J. Hum. Genet. 53 (5): 987–1000. PMC1682301. PMID 8213841.
- Nathans J, Piantanida T P, Eddy R L, Shows T B, Hogness D S, (1986). “Molecular genetics of inherited variation in human color vision”. Science 232 (4747): 203-210. PMID 3485310.
- Nathans J, Thomas D, Hogness D S, (1986). “Molecular genetics of human color vision: the genes encoding blue, green, and red pigments”. Science 232 (4747): 193-202. PMID 2937147
- Neitz J, Neitz M, (2011). “The genetics of normal and defective color vision”. Vision Res. 51 (7): 633–651. doi:1016/j.visres.2010.12.002.
- Neitz M, (2000). “Molecular Genetics of Color Vision and Color Vision Defects”. Archives of Ophthalmology. 118 (5): 691–700. doi:1001/archopht.118.5.691.
- Pinckers A, (1992) “Berson test for blue cone monochromatism”. Ophthalmol. 16 (3):185-186. PMID 1452423.
- Reitner A, Sharpe L T, Zrenner E, (1991). “Is colour vision possible with only rods and Blue sensitive cones?”. 352 (6338): 798–800. Bibcode:1991Natur.352..798R. doi:10.1038/352798a0. PMID1881435. S2CID 4328439.
- Reyniers E, et al. , (1995) “Gene conversion between red and defective green opsin gene in blue cone monochromacy”. Genomics 29, 323–328 (1995). – PubMed
- Semenov E P, Sheplock R, Roman A J, McGuigan D B, Swider M, Cideciyan A V, Jacobson S G, (2022) “Reading performance in blue cone monochromacy: defining an outcome measure for a clinical trial.” Transl Vis Sci Technol. 2020 Dec 8;9(13):13. – doi: 1167/tvst.9.13.13
- Sloan L L, Newhall S M, (1942). “Comparison of cases of atypical and typical achromatopsia”. American Journal of Ophthalmology. 25 (8): 945–961. doi:1016/S0002-9394(42)90594-4.
- Smallwood P M, Wang Y, Nathans J, (2002) “Role of a locus control region in the mutually exclusive expression of human red and green cone pigment genes”. Natl. Acad. Sci. U.S.A. 99, 1008–1011 (2002). – PMC – PubMed
- Spivey B E, (1965) “The X-linked recessive inheritance of atypical monochromatism”. Ophthalmol. 74 (3): 327–333. doi:10.1001/archopht.1965.00970040329007.
- Sumaroka A, Cideciyan AV, Sheplock R, Wu V, Kohl S, Wissinger B, Jacobson SG, (2020) “Foveal therapy in blue cone monochromacy: predictions of visual potential from artificial intelligence”. Front Neurosci. 2020 Aug 3;14:800. doi: 10.3389/fnins.2020.00800.
- Sumaroka A, Garafalo AV, Cideciyan AV, Charng J, Roman AJ, Choi W, Saxena S, Aksianiuk V, Kohl S, Wissinger B, Jacobson SG. (2018) “Blue cone monochromacy caused by the C203R missense mutation or large deletion mutations”. Invest Ophthalmol Vis Sci. 2018 Dec 3;59(15):5762-72. doi:https://doi.org/10.1167/iovs.18-25280
- Wang C., et al. , Novel OPN1LW/OPN1MW deletion mutations in 2 Japanese families with blue cone monochromacy. Genome Var. 3, 16011 (2016). – PMC – PubMed
- Wang Y., et al. , A locus control region adjacent to the human red and green visual pigment genes. Neuron 9, 429–440 (1992). – PubMed
- Wang, Y; Macke, J P; Merbs, S L; Zack, D J; Klaunberg, B; Bennett, J; Gearhart, J; Nathans, J (1992). “A locus control region adjacent to the human red and green visual pigment genes”. 9 (3): 429-440. PMID 1524826.
- Weale, RA (1953). “Cone Monochromatism”. The Journal of Physiology. 121 (3): 548–569. doi:1113/jphysiol.1953.sp004964.
- Winderickx J, Sanocki E, Lindsey DT, Teller DY, Motulsky AG, Deeb SS, (1992). “Defective colour vision associated with a missense mutation in the human green visual pigment gene”. Genet. 1 (4): 251–6. doi:10.1038/ng0792-251.
- Wissinger B, Baumann B, Buena-Atienza E, Ravesh Z, Cideciyan AV, Stingl K, Audo I, Meunier I, Bocquet B, Traboulsi EI, Hardcastle AJ, Gardner JC, Michaelides M, Branham KE, Rosenberg T, Andreasson S, Dollfus H, Birch D, Vincent AL, Martorell L, Català Mora J, Kellner U, Rüther K, Lorenz B, Preising MN, Manfredini E, Zarate YA, Vijzelaar R, Zrenner E, Jacobson SG, Kohl S, (2022) “The landscape of submicroscopic structural variants at the OPN1LW/OPN1MW gene cluster on Xq28 underlying blue cone monochromacy”. Proc Natl Acad Sci U S A. 2022 Jul 5;119(27):e2115538119. doi: 10.1073/pnas.2115538119.
- Xie B, Nakanishi S, Guo Q, Xia F, Yan G, An J, Li L, Serikawa T, Kuramoto T, Zhang Z. (2010) ”A novel middle-wavelength opsin (M-opsin) null-mutation in the retinal cone dysfunction rat”. Eye Res. (2010) 91 (1):26-33. PMID: 20371244.
- Yatsenko S. A., et al. , “High-resolution microarray analysis unravels complex Xq28 aberrations in patients and carriers affected by X-linked blue cone monochromacy”. Genet. 89, 82–87 (2016). – PMC – PubMed
- Zhang Z, Pang J, Xia F, Guo Q, Li L, An J, Zhang L, Hauswirth W W, Yang S, Li Z. “AAV-mediated Gene Therapy Restores Cone Function In A Rat With An M-cone Opsin Deficiency. A Model For Blue Cone Monochromacy”. PMID: 29386880.
- Zhang Y, Deng W T, Du W, Zhu P, Li J, Xu F, Sun J, Gerstner C D, Baehr W, Boye Sanford L, Zhao C, Hauswirth W W, Pang J, (2017) “Gene-based Therapy in a Mouse Model of Blue Cone Monochromacy”. Sci Rep 7, 6690 (2017). https://doi.org/10.1038/s41598-017-06982-7